2020年,國(guó)家藥品監督管理局以習近平新時代中國(guó)特色社會(huì)主義思想爲指導,堅持以人民爲中心的發(fā)展思想,嚴格落實“最嚴謹的标準”要求,統籌推進(jìn)疫情防控和監管工作,大力推動醫療器械标準化各項工作,爲醫療器械高質量發(fā)展提供堅強有力的保障。
一、疫情防控标準研究情況
(一)緊急研制疫情防控相關重點标準
緊急組織制定YY/T 1799-2020《可重複使用醫用防護服技術要求》,及時公開(kāi)标準文本。組織申報新冠病毒核酸檢測試劑和高流量呼吸治療設備專用安全等疫情防控相關6項國(guó)家标準立項,正按計劃制定。組織緊急制定《醫用防護口罩技術要求》《醫用一次性防護服技術要求》《心肺轉流系統 熱交換水箱》《心肺轉流系統 滾壓式血泵》《氣囊式體外反搏裝置》《一次性使用靜脈輸液針》6項疫情防控重點醫療物資國(guó)家标準英文版。
(二)積極申請疫情防控國(guó)際标準立項
在申報國(guó)家标準立項的基礎上,組織同步申報新冠病毒核酸檢測試劑和高流量呼吸治療設備專用安全等疫情防控相關國(guó)際标準立項。其中《醫用電氣設備 第2-90部分 高流量呼吸治療設備基本安全和基本性能(néng)》項目,國(guó)際電工委員會(huì)(IEC)和國(guó)際标準化組織(ISO)分别以94.4%和94.7%支持率高票獲得通過(guò),并由中國(guó)專家擔任該項目負責人,這(zhè)是由我國(guó)提出并成(chéng)功立項的首個新冠疫情防控相關醫療器械國(guó)際标準項目。
(三)全力做好(hǎo)疫情防控标準技術支撐
1. 開(kāi)展疫情防控醫療器械國(guó)内外标準比對(duì)。緊急組織開(kāi)展醫用防護口罩、醫用防護服、重症呼吸機、體外膜肺氧合器(ECMO)等26種(zhǒng)抗“疫”急需的重點保障醫療器械國(guó)内外标準關鍵技術指标對(duì)比分析。
2. 組織開(kāi)展醫用防護産品應急滅菌技術研究。組織起(qǐ)草《醫用一次性防護服輻照滅菌應急規範(臨時)》《醫用防護用品環氧乙烷滅菌後(hòu)加速解析應急參考方法(臨時)》,有效縮短了應急情況下醫用防護服、醫用口罩等投入使用的時間。
3. 積極組織開(kāi)展新冠疫情防控科研攻關。組織協調開(kāi)展國(guó)家“新型冠狀病毒感染的肺炎疫情應急項目”專項中“醫用防護服技術研究和産品開(kāi)發(fā)評價”課題研究。
二、醫療器械标準體系情況
(一)明确醫療器械強制性行業标準定位
2020年7月7日,國(guó)家藥監局印發(fā)《關于進(jìn)一步加強醫療器械強制性行業标準管理有關事(shì)項的通知》(藥監綜械注〔2020〕72号),明确了進(jìn)一步維護醫療器械強制性行業标準的法律地位,以及進(jìn)一步優化标準體系等具體要求。
(二)開(kāi)展“十四五”規劃前期研究
組織各單位在“十四五”藥品安全規劃的大框架下,結合醫療器械标準各技術領域産業發(fā)展和監管需求的實際,認真研究“十四五”時期醫療器械标準規劃。
(三)完善醫療器械标準關鍵環節管理程序
組織制定《醫療器械行業标準立項原則(試行)》《醫療器械國(guó)際标準化相關工作流程》,修訂《醫療器械标準審核要點》,印發(fā)醫療器械國(guó)際标準轉化原則及要求,提出醫療器械強制性标準制定新要求,進(jìn)一步規範、完善醫療器械标準關鍵環節工作流程和要求。
三、“十三五”标準制修訂任務完成(chéng)情況
嚴格按照《醫療器械标準管理辦法》《醫療器械标準制修訂工作管理規範》要求,組織、指導醫療器械标準化(分)技術委員會(huì)或技術歸口單位[以下統稱标委會(huì)(技術歸口單位)]按時保質完成(chéng)醫療器械标準制修訂任務。
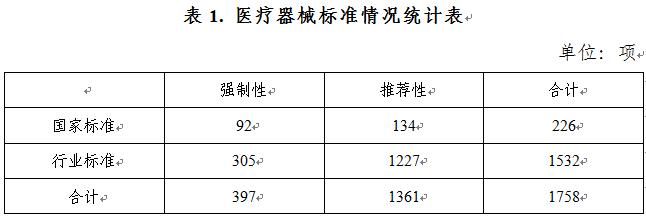
2020年下達醫療器械國(guó)家标準制修訂計劃27項,醫療器械行業标準制修訂計劃87項;發(fā)布醫療器械國(guó)家标準24項,醫療器械行業标準125項,醫療器械行業标準修改單10項。截至2020年12月31日,醫療器械标準共計1758項(見表1),醫療器械标準體系持續優化。
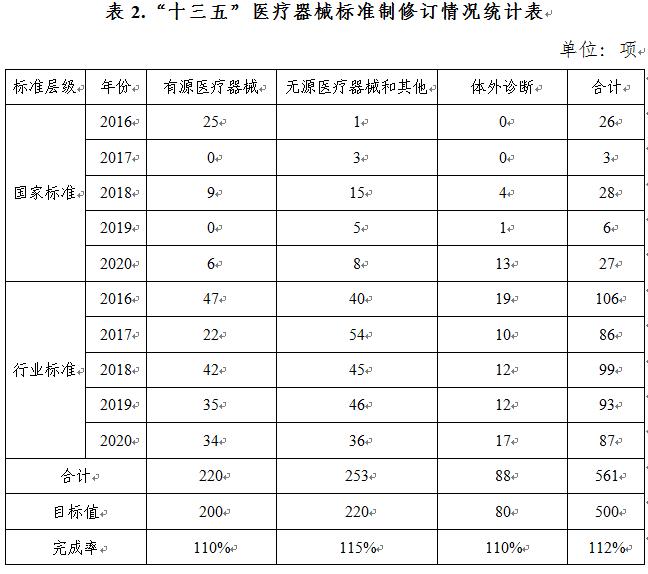
《“十三五”國(guó)家藥品安全規劃》中500項醫療器械标準制修訂任務已立項561項(見表2),超額完成(chéng)12%,“十三五”醫療器械标準質量提升專項計劃圓滿收官。
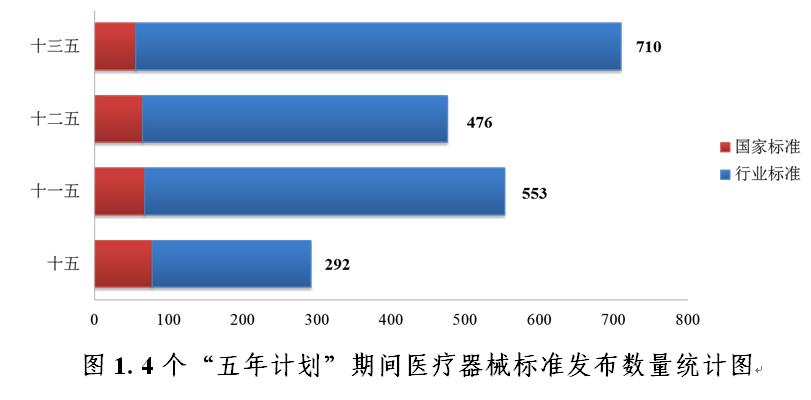
(一)标準數量大幅提升
“十五”“十一五”和“十二五”期間分别發(fā)布醫療器械标準292項、553項和476項。“十三五”期間,已發(fā)布醫療器械标準總數爲710項,較“十二五”期間增長(cháng)了49%,其中國(guó)家标準發(fā)布數量減少了15%,行業标準發(fā)布數量增長(cháng)了59%。2020年共發(fā)布醫療器械标準149項,标準發(fā)布數量較上一年度增長(cháng)了93%。自2001年“十五”實施以來醫療器械标準發(fā)布數量大幅提升(見圖1)。
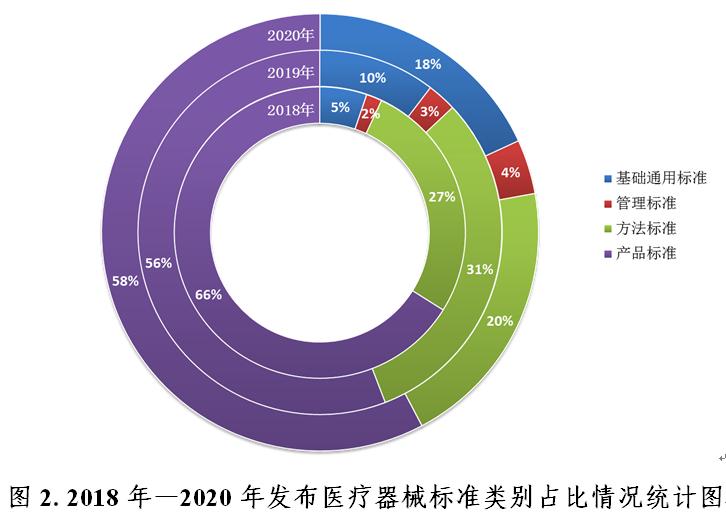
(二)标準結構組成(chéng)更加合理
截至2020年12月31日,按标準規範對(duì)象統計,現行有效的醫療器械标準中基礎标準286項,占比16%;管理标準54項,占比3%;方法标準422項,占比24%;産品标準996項,占比57%。
2020年發(fā)布的149項标準中,基礎标準27項、管理标準6項、方法标準30項、産品标準86項,基礎标準占全年發(fā)布标準比例逐年增高,由2018年的5%增長(cháng)到18%,醫療器械标準體系結構組成(chéng)更趨合理(見圖2)。
(三)标準領域覆蓋更加全面(miàn)
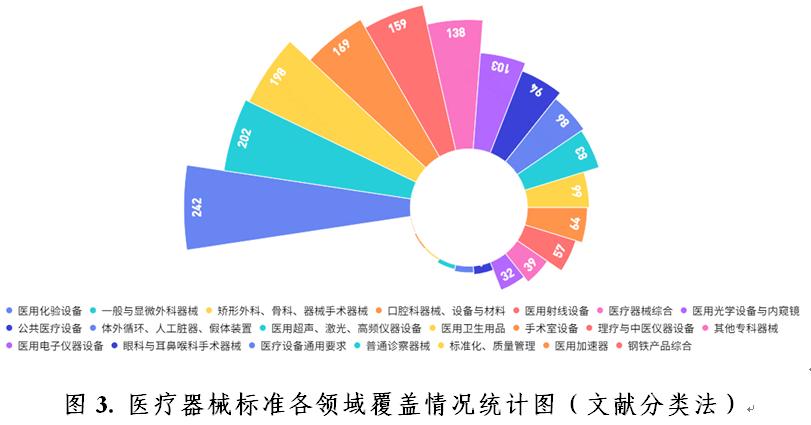
截至2020年12月31日,按标準規範對(duì)象統計,現行有效的醫療器械标準按照《中國(guó)标準文獻分類法》,主要歸類在醫療器械綜合(C30)至醫用衛生用品(C48)之間,占比前5位的分别是:醫用化驗設備(C44)14%,一般與顯微外科器械(C31)11%,矯形外科、骨科器械(C35)11%,口腔科器械、設備與材料(C33)10%,醫用射線設備(C43)9%(見圖3)。醫療器械标準基本覆蓋醫用電氣設備、手術器械、外科植入物等醫療器械各技術領域。
(四)标準約束力更加優化
按照《強制性國(guó)家标準管理辦法》《關于進(jìn)一步加強醫療器械強制性行業标準管理有關事(shì)項的通知》要求,進(jìn)一步優化完善醫療器械強制性國(guó)家标準和強制性行業标準體系。經(jīng)協調,2項醫用光學(xué)領域醫療器械強制性标準由工業和信息化部調整到國(guó)家藥品監督管理局。
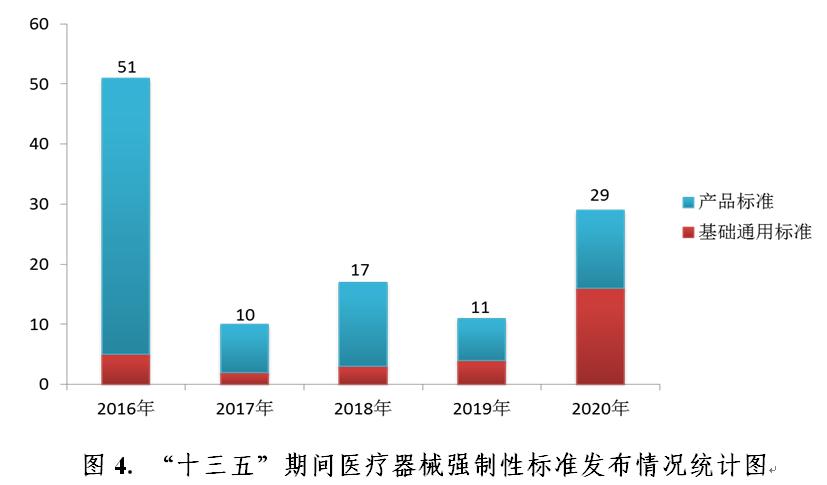
截至2020年12月31日,現行有效的醫療器械強制性标準共397項,占比23%。其中強制性國(guó)家标準92項,行業标準305項。397項醫療器械強制性标準中基礎通用标準 106項(占27%)、方法标準 2項(1%)、産品标準 289 項(72%)。基礎通用标準主要涉及産品通用安全和技術要求等方面(miàn);1項方法标準在2020年通過(guò)實施評價後(hòu)拟整合修訂爲醫療器械推薦性行業标準。2016年至2020年發(fā)布醫療器械強制性标準統計情況見圖4。
(五)醫用電氣設備安全标準發(fā)布實施
2020年4月,新版GB 9706.1-2020《醫用電氣設備 第1部分:基本安全和基本性能(néng)的通用要求》正式發(fā)布,將(jiāng)于2023年5月1日實施,是醫用電氣設備需要遵循的基礎通用安全标準。該标準及其并列、專用标準均采用IEC 60601系列國(guó)際标準,其中适于轉化的IEC 60601系列标準共74項。國(guó)家藥品監督管理局組織制定了一攬子标準轉化、編号、宣貫方案,有序推進(jìn)系列标準轉化。截至2020年12月31日,已發(fā)布15項标準,39項已完成(chéng)制修訂正在标準審核及出版社審校階段,15項正在制修訂中,需新轉化制定的5項專用安全标準正在申請國(guó)家标準立項。
四、标準組織架構建設情況
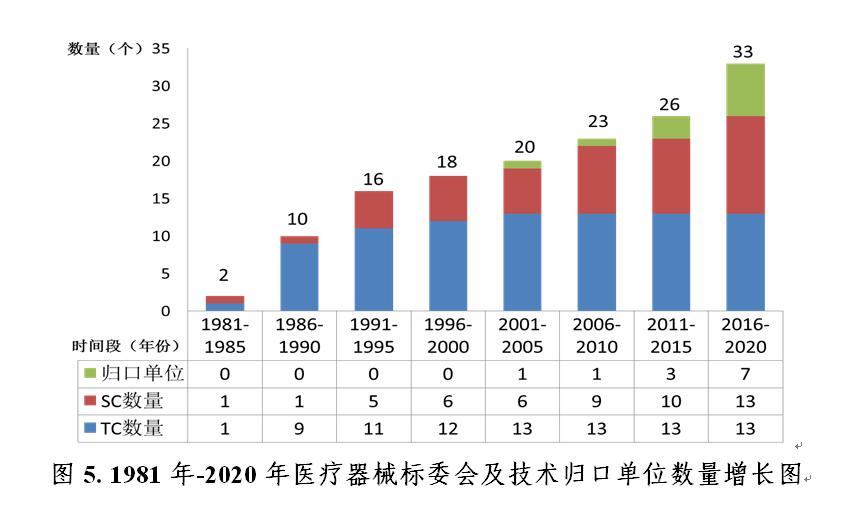
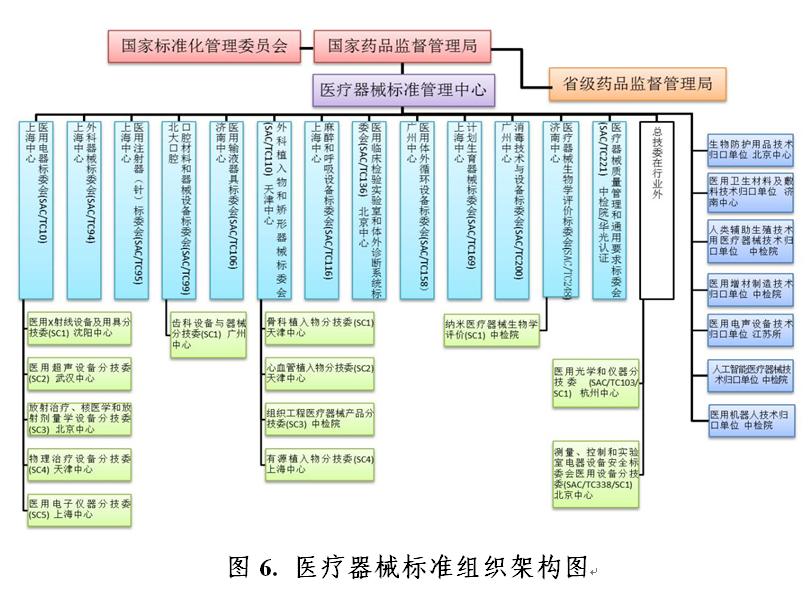
2020年,國(guó)家藥品監督管理局批準成(chéng)立醫用機器人标準化技術歸口單位,批準籌建的全國(guó)醫療器械臨床評價質量管理和通用要求标準化技術歸口單位正按程序推進(jìn)中。自1980年第一個醫療器械标委會(huì)成(chéng)立以來,标委會(huì)(技術歸口單位)數量已增長(cháng)到33個(見圖5),包括13個總标委會(huì)(TC)、13個分标委會(huì)(SC)和7個技術歸口單位。醫療器械标準組織架構見圖6。
五、标準精細化管理情況
(一)梳理醫療器械标準現狀
探索性開(kāi)展醫保目錄和一類醫療器械産品标準覆蓋情況調研,爲醫療器械标準立項奠定基礎。組織對(duì)2009年12月31日前發(fā)布的86項醫療器械強制性标準開(kāi)展标準實施評價,組織研提各技術領域醫療器械強制性标準制定原則,系統梳理存量醫療器械強制性标準,研提5年修訂計劃。
(二)建立國(guó)内外标準差異分析比對(duì)長(cháng)效機制
加強醫療器械标準國(guó)内外比對(duì)基礎性研究,明确在标準立項階段要提供與國(guó)際、國(guó)外區域或歐、美、日等國(guó)家标準的初步對(duì)比分析報告;在标準報批階段要就标準的重要技術指标和對(duì)應的試驗方法與國(guó)際、國(guó)外标準的差異進(jìn)行對(duì)比分析,并提供技術差異對(duì)比表,紮實做好(hǎo)醫療器械國(guó)内外标準差異分析技術儲備。
(三)強化标準宣貫培訓
制定并對(duì)外公布2020年醫療器械标準宣貫培訓,組織召開(kāi)醫療器械标準綜合知識線上培訓班,加強重要基礎通用标準宣貫解讀,在全國(guó)醫療器械安全宣傳周期間舉辦GB 9706.1-2020《醫用電氣設備 第1部分 基本安全和基本性能(néng)的通用要求》免費網絡培訓公開(kāi)課,共5900餘人參訓,進(jìn)一步統一對(duì)該标準的理解。
六、參與國(guó)際标準制修訂情況
(一)積極研提國(guó)際标準新項目
2020年共提出《醫用輸液器 第15部分:避光輸液器》《組織工程醫療産品-脫細胞基質支架材料的殘留DNA定量檢測方法》等9項醫療器械國(guó)際标準立項申請,其中1項已成(chéng)功立項,2項已通過(guò)成(chéng)員國(guó)同意,進(jìn)入項目立項(NP)投票階段。
(二)有序推進(jìn)國(guó)際标準制修訂
推動由我國(guó)主導或牽頭的8項醫療器械國(guó)際标準制定,其中由我國(guó)提出并成(chéng)功立項的首個新冠疫情防控相關醫療器械國(guó)際标準項目已結束國(guó)際标準草案(DIS)投票;《心血管植入物-心髒封堵器》《醫用輸液器 第15部分:避光輸液器》等2項國(guó)際标準項目已通過(guò)了委員會(huì)草案(CD)階段投票,進(jìn)入到DIS投票階段;《組織工程醫療産品 軟骨核磁評價 第1部分:采用dGEMRIC 和 T2 Mapping技術的臨床評價方法》由技術報告(TR)調整爲技術規範(TS),項目立項(NP)投票階段獲得成(chéng)員國(guó)一緻同意,進(jìn)入工作組草案(WD)讨論階段。
(三)鼓勵積極參與國(guó)際标準化活動
組織參加國(guó)際标準化會(huì)議20餘次,及時跟蹤國(guó)際标準新動态,代表我國(guó)參與國(guó)際标準投票共計150餘次。
七、标準信息公開(kāi)情況
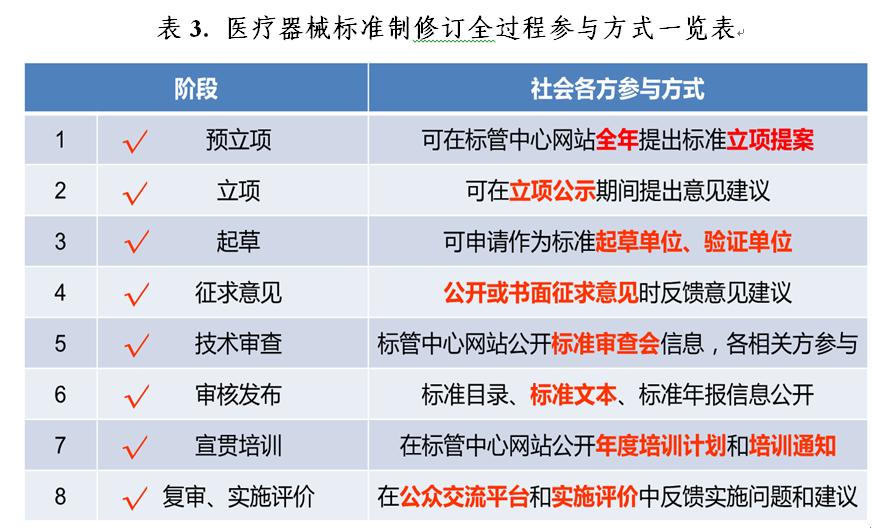
2020年,在國(guó)家藥品監督管理局醫療器械标準管理中心(以下簡稱标管中心)網站對(duì)外公開(kāi)322項醫療器械強制性标準文本和808項非采标推薦性标準文本,公開(kāi)率均爲100%。對(duì)外公開(kāi)征求182項醫療器械标準立項項目和125項标準征求意見稿及編制說明意見,公開(kāi)時間分别爲1個月和2個月。對(duì)外公開(kāi)了94項各标委會(huì)(技術歸口單位)醫療器械标準項目征集、委員征集、标準審定會(huì)等相關信息,鼓勵各方積極參與醫療器械标準制修訂工作。及時公布2020年度醫療器械标準宣貫計劃,加大标準宣貫的力度。對(duì)從标管中心公衆反饋平台反饋的137項意見建議及時進(jìn)行答複處理。建立了各相關方廣泛參與醫療器械标準制修訂全過(guò)程的機制(見表3)。
一、疫情防控标準研究情況
(一)緊急研制疫情防控相關重點标準
緊急組織制定YY/T 1799-2020《可重複使用醫用防護服技術要求》,及時公開(kāi)标準文本。組織申報新冠病毒核酸檢測試劑和高流量呼吸治療設備專用安全等疫情防控相關6項國(guó)家标準立項,正按計劃制定。組織緊急制定《醫用防護口罩技術要求》《醫用一次性防護服技術要求》《心肺轉流系統 熱交換水箱》《心肺轉流系統 滾壓式血泵》《氣囊式體外反搏裝置》《一次性使用靜脈輸液針》6項疫情防控重點醫療物資國(guó)家标準英文版。
(二)積極申請疫情防控國(guó)際标準立項
在申報國(guó)家标準立項的基礎上,組織同步申報新冠病毒核酸檢測試劑和高流量呼吸治療設備專用安全等疫情防控相關國(guó)際标準立項。其中《醫用電氣設備 第2-90部分 高流量呼吸治療設備基本安全和基本性能(néng)》項目,國(guó)際電工委員會(huì)(IEC)和國(guó)際标準化組織(ISO)分别以94.4%和94.7%支持率高票獲得通過(guò),并由中國(guó)專家擔任該項目負責人,這(zhè)是由我國(guó)提出并成(chéng)功立項的首個新冠疫情防控相關醫療器械國(guó)際标準項目。
(三)全力做好(hǎo)疫情防控标準技術支撐
1. 開(kāi)展疫情防控醫療器械國(guó)内外标準比對(duì)。緊急組織開(kāi)展醫用防護口罩、醫用防護服、重症呼吸機、體外膜肺氧合器(ECMO)等26種(zhǒng)抗“疫”急需的重點保障醫療器械國(guó)内外标準關鍵技術指标對(duì)比分析。
2. 組織開(kāi)展醫用防護産品應急滅菌技術研究。組織起(qǐ)草《醫用一次性防護服輻照滅菌應急規範(臨時)》《醫用防護用品環氧乙烷滅菌後(hòu)加速解析應急參考方法(臨時)》,有效縮短了應急情況下醫用防護服、醫用口罩等投入使用的時間。
3. 積極組織開(kāi)展新冠疫情防控科研攻關。組織協調開(kāi)展國(guó)家“新型冠狀病毒感染的肺炎疫情應急項目”專項中“醫用防護服技術研究和産品開(kāi)發(fā)評價”課題研究。
二、醫療器械标準體系情況
(一)明确醫療器械強制性行業标準定位
2020年7月7日,國(guó)家藥監局印發(fā)《關于進(jìn)一步加強醫療器械強制性行業标準管理有關事(shì)項的通知》(藥監綜械注〔2020〕72号),明确了進(jìn)一步維護醫療器械強制性行業标準的法律地位,以及進(jìn)一步優化标準體系等具體要求。
(二)開(kāi)展“十四五”規劃前期研究
組織各單位在“十四五”藥品安全規劃的大框架下,結合醫療器械标準各技術領域産業發(fā)展和監管需求的實際,認真研究“十四五”時期醫療器械标準規劃。
(三)完善醫療器械标準關鍵環節管理程序
組織制定《醫療器械行業标準立項原則(試行)》《醫療器械國(guó)際标準化相關工作流程》,修訂《醫療器械标準審核要點》,印發(fā)醫療器械國(guó)際标準轉化原則及要求,提出醫療器械強制性标準制定新要求,進(jìn)一步規範、完善醫療器械标準關鍵環節工作流程和要求。
三、“十三五”标準制修訂任務完成(chéng)情況
嚴格按照《醫療器械标準管理辦法》《醫療器械标準制修訂工作管理規範》要求,組織、指導醫療器械标準化(分)技術委員會(huì)或技術歸口單位[以下統稱标委會(huì)(技術歸口單位)]按時保質完成(chéng)醫療器械标準制修訂任務。
2020年下達醫療器械國(guó)家标準制修訂計劃27項,醫療器械行業标準制修訂計劃87項;發(fā)布醫療器械國(guó)家标準24項,醫療器械行業标準125項,醫療器械行業标準修改單10項。截至2020年12月31日,醫療器械标準共計1758項(見表1),醫療器械标準體系持續優化。
《“十三五”國(guó)家藥品安全規劃》中500項醫療器械标準制修訂任務已立項561項(見表2),超額完成(chéng)12%,“十三五”醫療器械标準質量提升專項計劃圓滿收官。


(一)标準數量大幅提升
“十五”“十一五”和“十二五”期間分别發(fā)布醫療器械标準292項、553項和476項。“十三五”期間,已發(fā)布醫療器械标準總數爲710項,較“十二五”期間增長(cháng)了49%,其中國(guó)家标準發(fā)布數量減少了15%,行業标準發(fā)布數量增長(cháng)了59%。2020年共發(fā)布醫療器械标準149項,标準發(fā)布數量較上一年度增長(cháng)了93%。自2001年“十五”實施以來醫療器械标準發(fā)布數量大幅提升(見圖1)。

(二)标準結構組成(chéng)更加合理
截至2020年12月31日,按标準規範對(duì)象統計,現行有效的醫療器械标準中基礎标準286項,占比16%;管理标準54項,占比3%;方法标準422項,占比24%;産品标準996項,占比57%。
2020年發(fā)布的149項标準中,基礎标準27項、管理标準6項、方法标準30項、産品标準86項,基礎标準占全年發(fā)布标準比例逐年增高,由2018年的5%增長(cháng)到18%,醫療器械标準體系結構組成(chéng)更趨合理(見圖2)。

(三)标準領域覆蓋更加全面(miàn)
截至2020年12月31日,按标準規範對(duì)象統計,現行有效的醫療器械标準按照《中國(guó)标準文獻分類法》,主要歸類在醫療器械綜合(C30)至醫用衛生用品(C48)之間,占比前5位的分别是:醫用化驗設備(C44)14%,一般與顯微外科器械(C31)11%,矯形外科、骨科器械(C35)11%,口腔科器械、設備與材料(C33)10%,醫用射線設備(C43)9%(見圖3)。醫療器械标準基本覆蓋醫用電氣設備、手術器械、外科植入物等醫療器械各技術領域。

(四)标準約束力更加優化
按照《強制性國(guó)家标準管理辦法》《關于進(jìn)一步加強醫療器械強制性行業标準管理有關事(shì)項的通知》要求,進(jìn)一步優化完善醫療器械強制性國(guó)家标準和強制性行業标準體系。經(jīng)協調,2項醫用光學(xué)領域醫療器械強制性标準由工業和信息化部調整到國(guó)家藥品監督管理局。
截至2020年12月31日,現行有效的醫療器械強制性标準共397項,占比23%。其中強制性國(guó)家标準92項,行業标準305項。397項醫療器械強制性标準中基礎通用标準 106項(占27%)、方法标準 2項(1%)、産品标準 289 項(72%)。基礎通用标準主要涉及産品通用安全和技術要求等方面(miàn);1項方法标準在2020年通過(guò)實施評價後(hòu)拟整合修訂爲醫療器械推薦性行業标準。2016年至2020年發(fā)布醫療器械強制性标準統計情況見圖4。

(五)醫用電氣設備安全标準發(fā)布實施
2020年4月,新版GB 9706.1-2020《醫用電氣設備 第1部分:基本安全和基本性能(néng)的通用要求》正式發(fā)布,將(jiāng)于2023年5月1日實施,是醫用電氣設備需要遵循的基礎通用安全标準。該标準及其并列、專用标準均采用IEC 60601系列國(guó)際标準,其中适于轉化的IEC 60601系列标準共74項。國(guó)家藥品監督管理局組織制定了一攬子标準轉化、編号、宣貫方案,有序推進(jìn)系列标準轉化。截至2020年12月31日,已發(fā)布15項标準,39項已完成(chéng)制修訂正在标準審核及出版社審校階段,15項正在制修訂中,需新轉化制定的5項專用安全标準正在申請國(guó)家标準立項。
四、标準組織架構建設情況
2020年,國(guó)家藥品監督管理局批準成(chéng)立醫用機器人标準化技術歸口單位,批準籌建的全國(guó)醫療器械臨床評價質量管理和通用要求标準化技術歸口單位正按程序推進(jìn)中。自1980年第一個醫療器械标委會(huì)成(chéng)立以來,标委會(huì)(技術歸口單位)數量已增長(cháng)到33個(見圖5),包括13個總标委會(huì)(TC)、13個分标委會(huì)(SC)和7個技術歸口單位。醫療器械标準組織架構見圖6。


五、标準精細化管理情況
(一)梳理醫療器械标準現狀
探索性開(kāi)展醫保目錄和一類醫療器械産品标準覆蓋情況調研,爲醫療器械标準立項奠定基礎。組織對(duì)2009年12月31日前發(fā)布的86項醫療器械強制性标準開(kāi)展标準實施評價,組織研提各技術領域醫療器械強制性标準制定原則,系統梳理存量醫療器械強制性标準,研提5年修訂計劃。
(二)建立國(guó)内外标準差異分析比對(duì)長(cháng)效機制
加強醫療器械标準國(guó)内外比對(duì)基礎性研究,明确在标準立項階段要提供與國(guó)際、國(guó)外區域或歐、美、日等國(guó)家标準的初步對(duì)比分析報告;在标準報批階段要就标準的重要技術指标和對(duì)應的試驗方法與國(guó)際、國(guó)外标準的差異進(jìn)行對(duì)比分析,并提供技術差異對(duì)比表,紮實做好(hǎo)醫療器械國(guó)内外标準差異分析技術儲備。
(三)強化标準宣貫培訓
制定并對(duì)外公布2020年醫療器械标準宣貫培訓,組織召開(kāi)醫療器械标準綜合知識線上培訓班,加強重要基礎通用标準宣貫解讀,在全國(guó)醫療器械安全宣傳周期間舉辦GB 9706.1-2020《醫用電氣設備 第1部分 基本安全和基本性能(néng)的通用要求》免費網絡培訓公開(kāi)課,共5900餘人參訓,進(jìn)一步統一對(duì)該标準的理解。
六、參與國(guó)際标準制修訂情況
(一)積極研提國(guó)際标準新項目
2020年共提出《醫用輸液器 第15部分:避光輸液器》《組織工程醫療産品-脫細胞基質支架材料的殘留DNA定量檢測方法》等9項醫療器械國(guó)際标準立項申請,其中1項已成(chéng)功立項,2項已通過(guò)成(chéng)員國(guó)同意,進(jìn)入項目立項(NP)投票階段。
(二)有序推進(jìn)國(guó)際标準制修訂
推動由我國(guó)主導或牽頭的8項醫療器械國(guó)際标準制定,其中由我國(guó)提出并成(chéng)功立項的首個新冠疫情防控相關醫療器械國(guó)際标準項目已結束國(guó)際标準草案(DIS)投票;《心血管植入物-心髒封堵器》《醫用輸液器 第15部分:避光輸液器》等2項國(guó)際标準項目已通過(guò)了委員會(huì)草案(CD)階段投票,進(jìn)入到DIS投票階段;《組織工程醫療産品 軟骨核磁評價 第1部分:采用dGEMRIC 和 T2 Mapping技術的臨床評價方法》由技術報告(TR)調整爲技術規範(TS),項目立項(NP)投票階段獲得成(chéng)員國(guó)一緻同意,進(jìn)入工作組草案(WD)讨論階段。
(三)鼓勵積極參與國(guó)際标準化活動
組織參加國(guó)際标準化會(huì)議20餘次,及時跟蹤國(guó)際标準新動态,代表我國(guó)參與國(guó)際标準投票共計150餘次。
七、标準信息公開(kāi)情況
2020年,在國(guó)家藥品監督管理局醫療器械标準管理中心(以下簡稱标管中心)網站對(duì)外公開(kāi)322項醫療器械強制性标準文本和808項非采标推薦性标準文本,公開(kāi)率均爲100%。對(duì)外公開(kāi)征求182項醫療器械标準立項項目和125項标準征求意見稿及編制說明意見,公開(kāi)時間分别爲1個月和2個月。對(duì)外公開(kāi)了94項各标委會(huì)(技術歸口單位)醫療器械标準項目征集、委員征集、标準審定會(huì)等相關信息,鼓勵各方積極參與醫療器械标準制修訂工作。及時公布2020年度醫療器械标準宣貫計劃,加大标準宣貫的力度。對(duì)從标管中心公衆反饋平台反饋的137項意見建議及時進(jìn)行答複處理。建立了各相關方廣泛參與醫療器械标準制修訂全過(guò)程的機制(見表3)。








